「せりか基金」を支援してくださっているみなさま、せりか基金のみなさま、ALS研究のご支援ありがとうございます!
『宇宙兄弟』全巻と複製原画が届きました!

「せりか基金」を支援してくださっているみなさま、せりか基金のみなさま、ALS研究のご支援ありがとうございます!
『宇宙兄弟』全巻と複製原画が届きました!

これまでは、RNAやDNAに結合する性質を持ったTDP-43が液滴や顆粒状の塊として、細胞の様々な場所で働いていることを見てきました。健康な細胞にあるTDP-43の塊と、筋萎縮性側索硬化症(ALS)で変性した運動ニューロンに溜まる塊は、どのように違うのでしょうか?
ALSの運動ニューロンで蓄積するTDP-43の異常な塊は、その形の特徴から大きく分けて2つに分類できます。丸型(英語では、rounded)と、かせ型(skein-like)です。かせ型とは、巻き取られた糸の束のような形のことです。このように、少なくとも2種類の塊があるということは、異常な塊のでき方も2通りあると考えられています。

ALSの5~10%は、病気の原因となる遺伝子変異を一つに絞ることができます。このような原因遺伝子には、RNAの機能に関連するものと、細胞の中の骨組み(細胞骨格、さいぼうこっかく)に関係するもの、などがあります。培養細胞をつかった実験では、RNAの機能に関連するALSの原因遺伝子を操作すると丸型のTDP-43の塊ができやすく、細胞骨格に関連する原因遺伝子を操作すると、かせ型の塊ができやすい、という研究成果も報告されています。
また、ある種のストレス下の細胞では、TDP-43分子の中央部にあるRNAに結合する領域にアセチル基という“タグ分子”が付加されることが知られています。このようなアセチル基が付加されたTDP-43をALSの運動ニューロンで検出してみると、なんと、かせ型の塊が染まることが報告されています。このことは、運動ニューロンが周囲からうけるストレスの種類が、TDP-43の塊の種類を決めている可能性を示しています。
ALSや一部の認知症で蓄積するTDP-43の塊は、少しずつ異なった形をもっていて、病気の進行度などが、塊の形のよって異なっていることが知られています。このような塊を抽出して、培養細胞に加えると、その細胞には、それぞれの形を受けついだ塊ができることが知られています。このように、塊の性質が細胞と細胞をまたいで受け継がれることから、TDP-43が、タンパク質から成る感染性因子「プリオン」としての性質を持っている可能性が考えられます。このようなプリオンのような性質を利用してTDP-43が運動ニューロンと運動ニューロンの間を伝わっていくとすると、運動ニューロンだけが変性する、というALSの特性が説明できるのではないか、と予想されています。
さらに、最近では、細胞と細胞が小さな小胞(微細小胞)を介して、物質のやりとりをしていることが明らかにされています。プリオンのような性質ではなく、微細小胞を介してTDP-43が運動ニューロン間に伝搬されている、という考えも提唱されています。
これまで紹介してきたように、一口にTDP-43の塊といっても、健康な細胞で作られるもの、異常な細胞で作られるもの、さらにそのそれぞれにおいて、異なる性質をもった塊が複数種類あります。
このようなTDP-43の塊を理解することができれば、 ALSで運動ニューロンだけが変性しやすいという現象の理解にたどり着くことができるのでしょうか?
次に章からは、TDP-43に着目することで、運動ニューロンだけが変性するというALSの大きな謎を解けるのか、否か、という点を議論していきたいと思います。
細胞に凍てる雫、TDP−43液滴とALSの接点を探る(12)へ続く
出典
筋肉の伸び縮みをコントロールする神経細胞「運動ニューロン」の形や機能が失われてしまう難病、筋萎縮性側索硬化症(ALS)では、運動ニューロンにTDP-43とよばれるDNAやRNAに結合するタンパク質の塊が蓄積することが知られています。
実は、TDP-43は、運動ニューロンでだけはなくて、人間の体をつくるほとんどの細胞で働いていて、様々な機能を発揮しています。
例えば、筋肉の細胞(筋細胞)で、TDP-43の量が少なくなると、加齢に伴う筋力の低下が加速することが、マウスや昆虫を使った研究から明らかになっています。また、ゼブラフィッシュという熱帯魚を使った研究では、TDP-43の量が少なくなると、筋細胞の形や機能が徐々に失われてしまうことが報告されています。
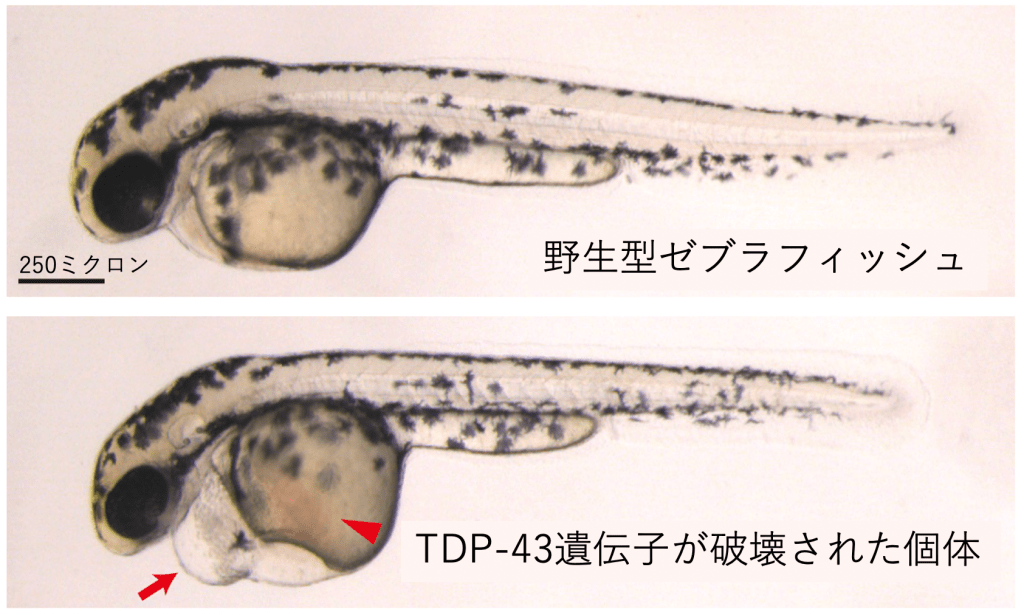
では、筋細胞ではTDP-43はどのような働きを担っているのでしょうか。
筋細胞から作られた培養細胞でも、他の細胞種と同じように、TDP-43は、遺伝情報が収納された細胞核に豊富にあります。これに加えて、細胞核の外(細胞質)では、50~250ナノメートルの水に溶けにくい繊維(アミロイド)を形成していることが近年発見されました。
このアミロイド状のTDP-43繊維は、Myo-granuleと呼ばれています(ここでは、筋顆粒、きんかりゅう、と呼びます)。この筋顆粒は、筋肉の伸び縮みのもとになる“バネ”の性質をもったタンパク質をつくるためのRNAを含んでいて、筋細胞が作られるときや、損傷から再生される時には、なくてはならない役割を担っています。
この筋細胞の再生における振る舞いに似ていますが、TDP-43は、筋肉と接続するために必要な運動ニューロンのケーブル(神経軸索)が切断されると、一過的に運動ニューロンの細胞質におけるTDP-43の量を増やして顆粒を形成することが知られています。
このような研究から、細胞質でTDP-43の塊が形成されるという現象は、ALSのような異常な状況においてだけでなく、健康な筋細胞が、様々な細胞内外の環境変化に対処する過程でもおこることが明らかにされてきています。TDP-43の塊は、細胞の種類によって、さらには、同じ細胞種でも老化の度合いによって、有益であったり、反対に有害であるのではないか、と考えられています。
最後に、正常な筋細胞でTDP-43が溶けにくい塊(アミロイド状の繊維)を形成しているという発見は、運動ニューロンに溜まる異常なTDP-43の塊の源を突き止める上で、頭の片隅に置いておかなくてはならないものです。TDP-43分子の中にある決まった形をとらない領域(天然変性領域)は、細胞と細胞の間を移動できる(伝搬する)性質をもったプリオンというタンパク質に似ていることが知られています。ALSの運動ニューロンに溜まるTDP-43の異常な塊の源が、実は、運動ニューロン自身ではなく、筋細胞から伝搬したTDP-43のアミロイドに由来するのか、という可能性は今のところ推測の域を全く出ませんが、将来、検証の必要はあるかもしれません。
次は、運動ニューロンに溜まる異常なTDP-43の塊の性質について、紹介したいと思います。
細胞に凍てる雫、TDP−43液滴とALSの接点を探る(11)へ続く
出典
健康な細胞は、成長や分裂に必要なタンパク質を供給するために、遺伝情報が記されているDNAを、RNAに写しとって、それをタンパク質に翻訳するという作業を脈々と続けています。
しかし、細胞の一生のなかでは、栄養が急になくなってしまったり、急激に温度が変化したり、物理的な衝撃で損傷したり、など、危機(ここでは細胞ストレスと呼びます)にさらされることがあります。細胞ストレスに見舞われた時、健康に過ごしていた細胞は、ストレスの前と同じように、タンパク質を作り続けるのでしょうか?
実は、そういうわけにはいかなくて、細胞は生き延びるために、健康な時に必要とされていたタンパク質の供給を一旦停止して、代わりに、細胞ストレスに対応するためのタンパク質を合成して、急場を凌ぎます。
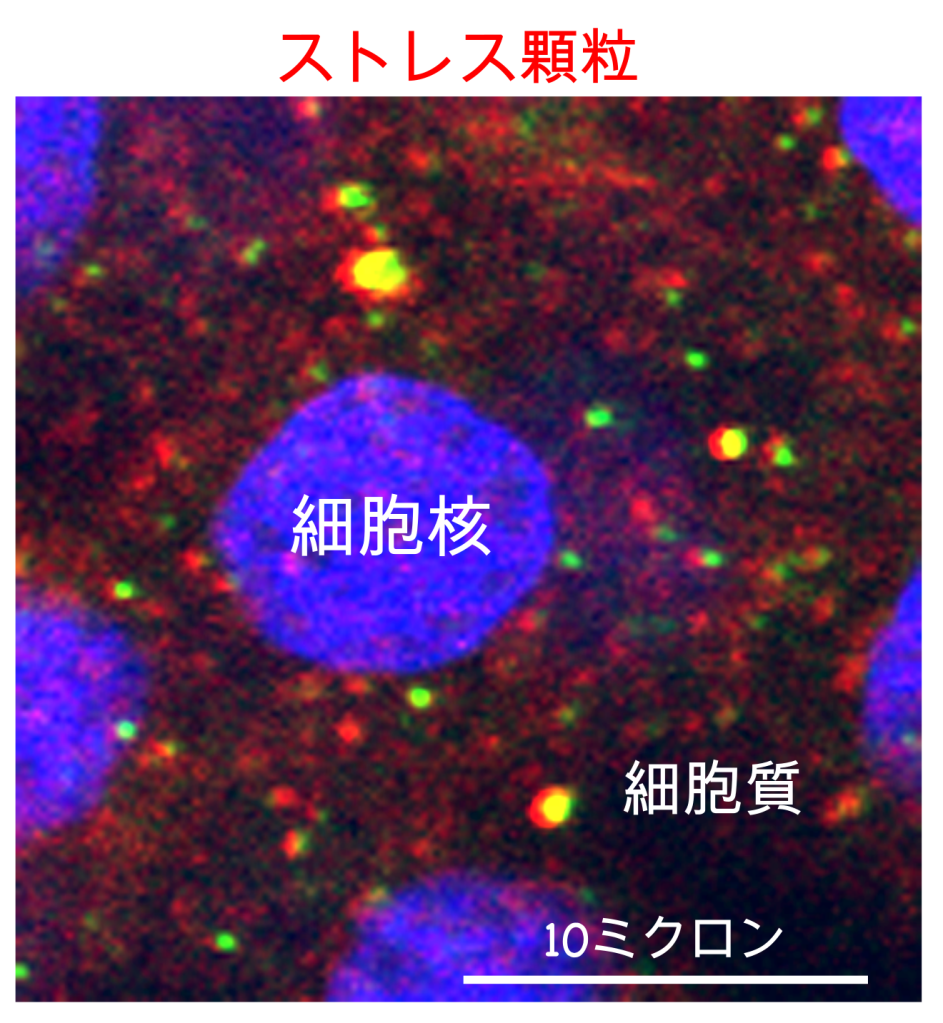
細胞ストレスを感じて、タンパク質の供給を一旦停止する時に、細胞は、タンパク質を翻訳していたRNAと翻訳装置を、ごそっと塊にしてストレス顆粒(ストレスかりゅう、英語では、Stress granule)とばれる大きな粒を作ります。細胞ストレスが去ったときには、このストレス顆粒が解消され、解放されたRNAと翻訳装置は、再び、健康状態を維持するためのタンパク質を開始します。RNAと翻訳装置を壊してしまうと、また一から作るのは大変ですが、再利用できるようにストレス顆粒として一旦しまっておくのは、合理的です。
ストレス顆粒は、細胞ストレスに応じて一過的に作られますが、筋萎縮性側索硬化症(ALS)で変性して失われる神経細胞「運動ニューロン」に溜まる異常なタンパク質の塊の源になっているのではないか?という説が提唱されています。細胞ストレスが、何度も繰り返されたり、常態化すると、ストレス顆粒の解消がいつしか不完全になり、解消しきれなかったストレス顆粒の残骸が、やがては異常な塊となって運動ニューロンに蓄積する、という予想です。
ALSの運動ニューロンに蓄積する異常なタンパク質の塊は、TDP-43というタンパク質が主成分として含まれていますが、TDP-43は、一部のストレス顆粒に含まれていることが知られています。また、ALSの原因となるTDP-43の変異の一部には、細胞ストレスが加わると、TDP-43を細胞核から漏れ出やすくして、細胞質にあるストレス顆粒に移行しやすくする効果があります。解消が不十分なストレス顆粒の残骸に、TDP-43が含まれていて、それがALSでは異常な塊に成長するのでしょうか。ALS発症の平均年齢が55歳ぐらいと言われていますから、この予想が正しいとしても、長い期間をかけてストレス顆粒のTDP-43が異常な塊に成長することを証明するのは、容易ではありません。
一方で、近年の研究では、ある条件でTDP-43の塊を形成させると細胞が損傷を受けることがわかってきていますが、その時に形成されるTDP-43の塊には、ストレス顆粒に含まれる他のタンパク質は検出できないことも明らかにされています。このような研究結果からは、ALSに見られるTDP-43の異常な塊は、ストレス顆粒に由来しない別のルートで作られる、という考えが提唱されています。
97%のALSでは、運動ニューロンにTDP-43の異常な塊が形成されることが知られています。その異常な塊の源はなんなのか?という問題が解ければ、ALSの原因の理解が大きくすすむと期待されています。TDP-43の異常な塊が、ストレス顆粒が進化したものなのか、ストレス顆粒とは別のルートで作られるのか?あるいは、両方とも正しいのか、誤っているのか?という論争の解決は、重要な課題です。
TDP-43が細胞内につくる塊には、ALSの運動ニューロンに見られるような異常な塊がよく知られていますが、実は、筋肉の細胞ではある種のTDP-43の塊が、筋肉の形成のための重要な働きを担っていることが知られています。次はこのことについて解説します。
細胞に凍てる雫、TDP−43液滴とALSの接点を探る(10)へ続く
出典
遺伝情報が書き込まれているDNAは、細胞核(さいぼうかく)とよばれる丸い袋状の区画に収納されています。そのDNAの情報が読み出されて作られるタンパク質は、細胞核だけでなく、その外側の細胞質(さいぼうしつ)を含む細胞のいたる所で働いています。人間がもっているおよそ2万種類の遺伝子から作られる多様なタンパク質は、それぞれ働く“持ち場”を持っています。例えば、子孫細胞に遺伝情報を引き継ぐためにDNAをDNA にコピーする(複製する)タンパク質は、細胞核の中に豊富にあります。一方で、隣の細胞と接着するための細胞と細胞のつなぎ目になるタンパク質は、細胞の一番外側の細胞膜を貫通して、隣の細胞と接触できるようになっています。
タンパク質を、それぞれの持ち場に無駄なく効率よく供給ために、DNAが読み取られてできるRNAという“DNAの友達”を、すぐにタンパク質に翻訳するのではなく、RNAを持ち場まで運んでから翻訳する、という能力が細胞には備わっています。RNAをあらかじめタンパク質の持ち場まで運ぶことは、形が複雑な細胞、例えば、神経細胞のように細長い細胞などでは特に重要です。

例えば、筋肉を収縮させる神経細胞「運動ニューロン」は、背骨の中を通っている脊髄(せきずい)という組織にDNAが収納された細胞核を持っています。そこから、相手方になる筋肉に向かって、神経軸索(しんけいじくさく)という細長いケーブルを伸ばしています。成人の腕の長さが、おおよそ70センチメートルと言われていますから、手の指の筋肉を収縮させる運動ニューロンは、70センチメール以上のケーブルを伸ばしています。
運動ニューロンでは、筋肉との接続に必要なタンパク質の作り方は、脊髄にあるDNAに書かれていますが、そのDNAの情報がRNAに読み取られると、脊髄でRNAからタンパク質を作って筋肉の方向に運んでいくのではなく、まずRNAを筋肉の近くに運んでからタンパク質を作る、という制御があることが知られています。軸索のケーブルが腕の中を走行して指先に到達する運動ニューロンは、70センチメール以上もRNAを運んでいることになります。
この総説で注目するTDP-43というタンパク質は、細胞核に豊富に含まれるタンパク質ですが、細胞質ではRNAの輸送に深く関わっていることが知られています。RNAと結合したTDP-43は、バラバラに細胞の中で浮かんでいるのではなく、集合して液滴をつくります。その液滴が、細胞の中に敷かれたレールを走っている、いわば“貨物列車”ともいうべきモータータンパク質に乗車して、まとまって細胞の先端まで運ばれていったり、あるいは、先端から細胞核の近くに戻ってきたりしています。
興味深いことに、筋萎縮性側索硬化症(ALS)の原因となるTDP-43の変異がおこると、神経細胞の軸索ケーブルの中を行き交うTDP-43液滴の「行き(筋肉の方向へ)」と「帰り(細胞核の方向へ)」が、「帰り」側にかたよってしまうことが明らかにされています。その結果として予想されることは、TDP-43とRNAの液滴が、軸索ケーブルの先端に少なく、細胞核側に多い、というかたよった状態です。つまり、TDP-43の変異によって、筋肉との接続やコミュニケーションを担うタンパク質が、本来の持ち場に供給されにくくなってしまっている可能性が考えられます。
このようなトラブルをもたらすTDP-43の変異は、TDP-43が本来持っているサラサラの液体のように自由に形をかえる性質を低下させ、代わりに粘り気を増加させることがわかってきています。健康な状態では、TDP-43の液体のような性質が、RNAをタンパク質の持ち場まで、まとめて運ぶのを助けていますが、この性質が失われると、運動ニューロンがALSのような状態に向かうのかもしれません。
次は、細胞質における、もう一つのTDP-43液滴の姿、「ストレス顆粒(かりゅう)」について紹介します。
細胞に凍てる雫、TDP−43液滴とALSの接点を探る(9)へ続く
出典
健康な細胞の中のTDP-43タンパク質は、遺伝情報が収納されている細胞核(さいぼうかく)という球形の区画の中に豊富にあります。
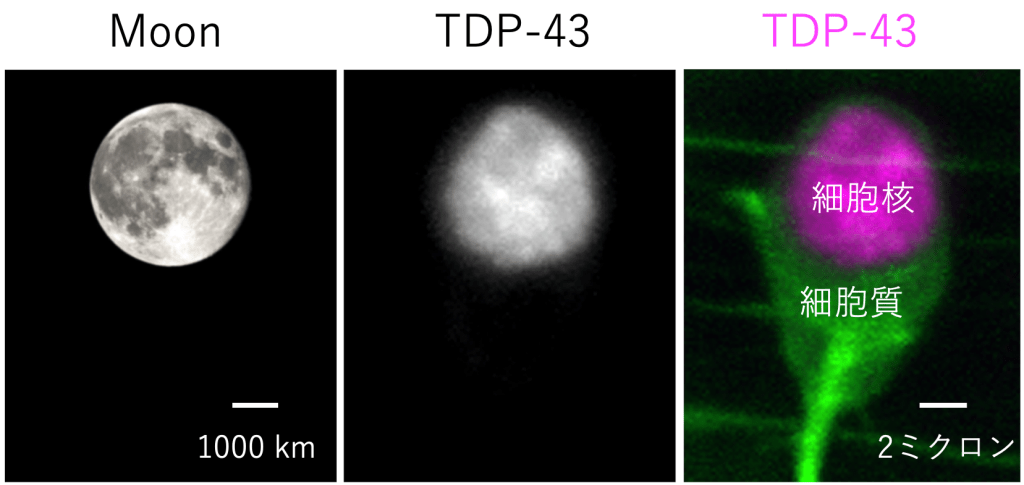
細胞核の内側をよくのぞいてみると、満月に光の濃淡があるかの如く、TDP-43の分布は不均一で、ある種の構造を作っていることがわかります(図)。このような構造体は、核内構造体(かくないこうぞうたい)、あるいは、Nuclear body(ヌークリアー ボディー)、などと総称されているので、以下、NBと総称します。NBは均一ではなく、様々な種類があることが知られています。
顕微鏡でさらに詳しく観察してみると、NBを形作るTDP-43は液滴のようにみえますが、その中にあるTDP-43分子は、液滴の外のTDP-43分子と一定の割合で置き換わり続けています。あたかも、コップの外側についた水滴がじっとしているように見えても、実は、コップに冷やされて液体になる水分子と、水滴から空気中へ蒸発する水分子の出入りがあるのと似ています。
例えば、TDP-43が、パラスペックルと呼ばれるNBに多く留まるようになると、タンパク質を作るためのRNAを制御するTDP-43の機能が低下する例が知られています。つまり、TDP-43が液滴をつくる性質と、RNAを制御する性質は密接に関わっていることがわかります。
細胞がストレスにさらされると、TDP-43を含んだNBは、細胞核内の分布を大きく変化させます。たとえば、細胞内に活性酸素を発生させるようなストレスを加えると、細胞核のTDP-43は、通常の状態よりもよりはっきりとした液滴を形成するようになります。この時、TDP-43は、結合するRNAの種類を変えて液滴を変化させていることが知られています。
細胞にストレスがかかるとTDP-43液滴の形成が促進されることに、いったい、どのような意味があるのか、正確にはわかっていません。しかし、数あるALSの原因となるTDP-43の変異のうち、RNAに結合しにくくなるような変異がおこると、ストレスが与えられてもTDP-43液滴の形成が促進されなくなり、その代わりに、細胞核の外側(細胞質、さいぼうしつ)のTDP-43の量が増えることが、近年明らかにされました。ALSでは、細胞質にTDP-43の異常な塊が形成されることが知られていますので、一説には、細胞核でTDP-43液滴を作ることは、細胞質に漏れ出るTDP-43の量を減らすことで、細胞を健康に保つ効果があるのではないか、という考え方が提唱されています。
また、TDP-43の量が減少すると、遺伝情報が書き込まれたDNAに起こる損傷が、修復されにくくなることが知られています。このことから、TDP-43はDNAの修復に必要であることが分かりますが、RNAと結合する性質を利用してDNAを修復するのか?、また、そのような機能には液滴を作る性質が必要なのか?については未解明であり、今後の重要な研究課題であると考えられています。
このように、細胞核の内側にあるTDP-43は、細胞の状態に応じて柔軟に形を変えて、細胞の健康を維持しています。
次の章では、細胞核の外側のTDP-43の働きを解説します。
細胞に凍てる雫、TDP−43液滴とALSの接点を探る(8)へ続く
出典