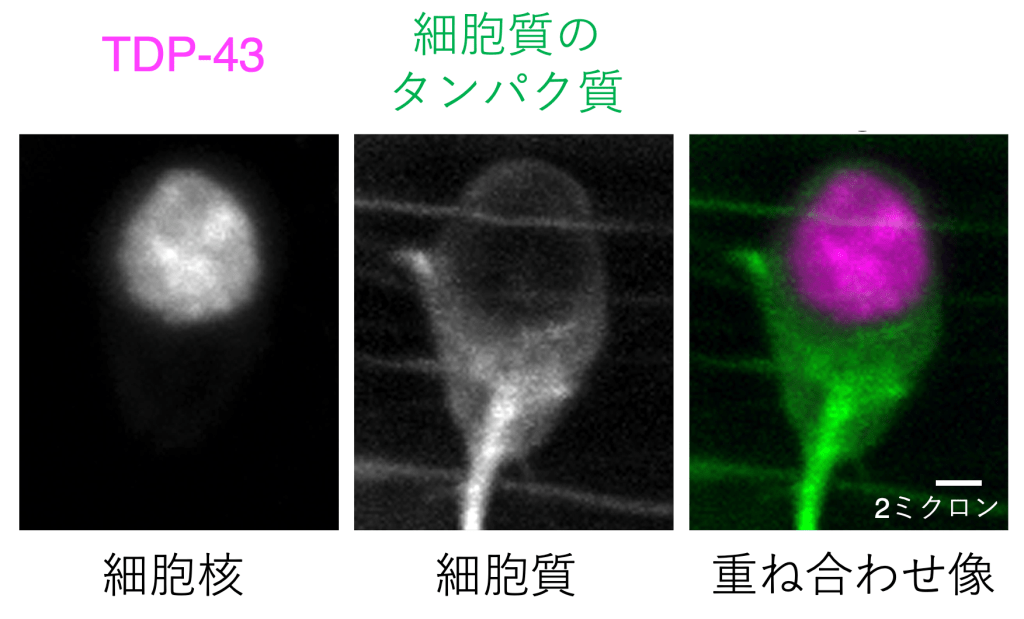
TDP-43は、414個のアミノ酸が数珠つなぎになってできるタンパク質です。
この414個のアミノ酸は、ある程度決まった形に折りたたまれる領域と、一定の形をとらずに柔軟に形を変える領域があります。
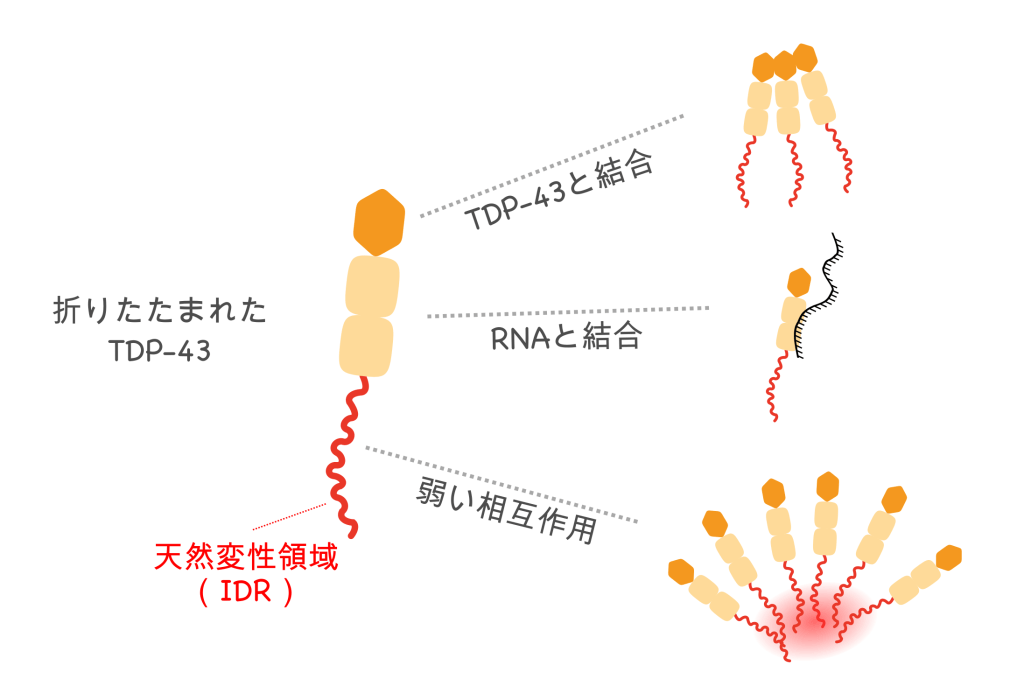
TDP-43のはじめの100アミノ酸ほどの領域が折りたたまれると、自分自身と会合する性質を発揮します。この性質を利用して、TDP-43同士は互いに結合することができます。この性質に加えて、この領域には、細胞内のどこにTDP-43を運んだらよいのか、あるいは、TDP-43を分解するのか、しないのか、などの情報が書き込まれていることがわかってきています。つまり、自分自身と会合したり、細胞内を運ばれたり、分解されたり、といったTDP-43分子の性質は、お互いに影響し合っていると予想できます。このような複雑に入り組んでいるTDP-43の制御の仕組みは、徐々にあきらかにありつつあります。
はじめの100アミノ酸に続く、次の150アミノ酸には、RNAと結合する性質をもった領域を2つ含んでいます。この2つのRNA結合領域は、それぞれ異なる性質をもったRNAに親和性をもっていて、細胞内の状況に応じて、TDP-43が結合するRNAを変化させる為に、使い分けられています。また、この領域のアミノ酸が遺伝子変異などによって変化すると、TDP-43がRNAと結合しにくくなり、異常なTDP-43の塊が生まれやすいことが知られています。このことから、RNAと正常に結合できなくなることが、ALSで見られるような異常なTDP-43の塊が生まれる原因である、と一説には予想されています。
RNAとの結合領域に続く、残りの150アミノ酸は、アミノ酸の組成が偏っていて(グルタミンやアスパラギンが多く含まれる)、アミノ酸同士の強い結合で決まった形に折りたたまれるのではなく、弱い結合を利用して状況に応じて柔軟に形を変化させる性質があります。この性質から、天然変性領域(てんねんへんせいりょういき)と呼ばれています。弱い結合を利用して集合することで、液体のように振舞うことができます。あたかも、水分子が弱い力で結合すると液体(みず)として柔軟に形を変えることができるように、TDP-43が液滴として振舞う為に、この天然変性領域を介した弱い結合が、重要な役割を果たしていると考えられています。
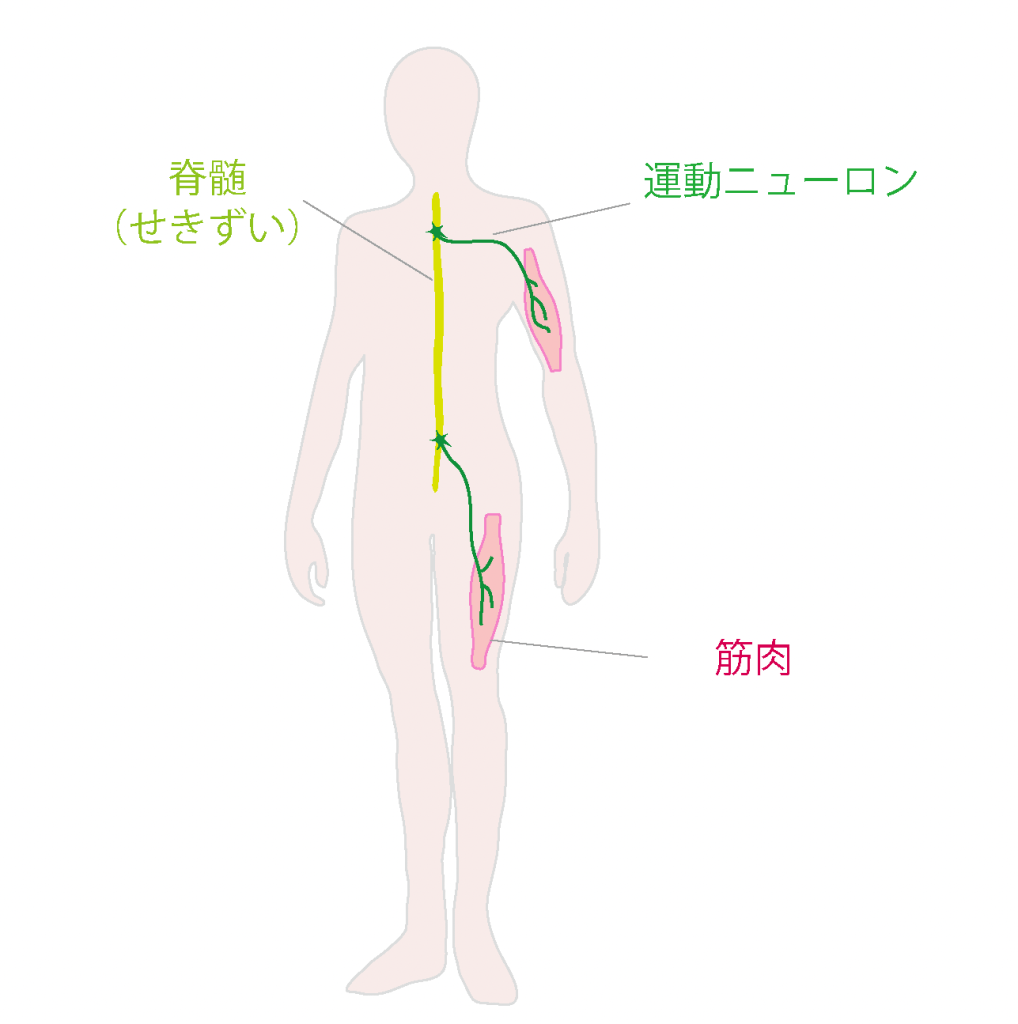
筋萎縮性側索硬化症(ALS)は、一つの遺伝子の変異が原因となって発症するケース(ALSが遺伝するケース)は、ALS全体の10%に満たないとされています。この10%に満たない遺伝性のALSのごく一部に、TDP-43の変異が原因となって発症するケースが報告されています。このようなTDP-43変異は、ほとんどの場合、天然変性領域のアミノ酸が別のアミノ酸に変化する変異であることがわかっています。したがって、液体のように柔軟に形を変化させるTDP-43の性質に何らかの異常がおこることが、ALSの発症と密接に関わっているのではないか、と予想されています。
次は、TDP-43が、細胞の中で作る液滴について紹介ていきたいと思います。
細胞に凍てる雫、TDP−43液滴とALSの接点を探る(7)へ続く
出典